
[쿠키뉴스] 유수인 기자 = 국내 개발 진단시약 73개 제품이 수출용으로 허가되면서 미국, 이탈리아, 브라질 등 110여개국에 약 5600여만분의 진단시약 수출이 이뤄지고 있는 것으로 나타났다.
특히, 우리나라 진단시약 7개 제품은 미국 FDA의 긴급사용승인을 받아 미국 등으로의 진출이 더욱 확대될 것으로 전망된다.
22일 식품의약품안전처에 따르면, 5월 20일 기준 유전자 50개, 면역 23개 진단시약이 수출용으로 허가되면서 미국, 이탈리아, 브라질, 사우디아라비아, 이집트, 인도네시아 등 110여개국에 약 5646만명분(5월19일기준)의 진단시약이 수출됐다.
식약처는 그간 긴급사용 승인 등 신속한 대응으로 K-방역 시스템의 핵심인 코로나19 진단시약의 글로벌 위상이 높아졌다고 평가하며, 긴급사용승인과 수출용 허가의 정식허가 전환, 진단시약 등 체외진단제품에 대한 체계적인 허가 지원 시스템 구축, 진단기법 등의 국제 표준화 추진을 꼼꼼히 준비하면서 포스트 코로나 시대에도 K-방역의 명성을 확고히 하겠다는 방침이다.
실제로 식약처는 코로나19 발발 이후 서류평가, 임상성능평가, 전문가 회의 등을 신속하게 진행해 현재 총 6개 제품이 긴급 승인된 상태이며, 현재 10개 제품에 대한 임상성능평가가 진행되고 있다.
국내 긴급사용 승인 6개 제품은 1일 최대 생산량은 약 15만명분으로 20일자 누적 총생산량은 150만명분이다.
이날 기준 국내에는 이 중 131만명분이 공급됐고, 지금까지 총 76만건의 검사가 진행됐다. 현재 약 19만명분을 재고로 확보해 안정적인 수급을 이어가고 있다.
또 식약처는 질병관리본부와 협의해 검체 전처리부터 결과도출까지 1시간 이내로 분석 가능한 ‘응급용 유전자 진단시약’에 대한 긴급사용 승인 절차 및 기준을 마련하기도 했다.
기존 긴급사용 승인 제품이 진단에 6시간이 걸리는데 비해 응급진단시약은 검사시간을 1시간 내로 단축했기 때문에, 응급수술 등 시급한 조치가 필요한 환자에 대한 긴급검사 목적으로만 사용할 예정이다.
신청접수 시 임상성능평가, 전문가 검토 등을 거쳐 일정수준 이상 성능기준을 충족한 제품은 신속 승인할 예정이다.
아울러 긴급사용 승인 제품과 수출용 허가 제품의 정식허가로의 전환을 통해 K-진단시약의 품질에 대한 글로벌 신뢰도를 높이고, 이를 위한 단계별 밀착 지원도 강화한다.
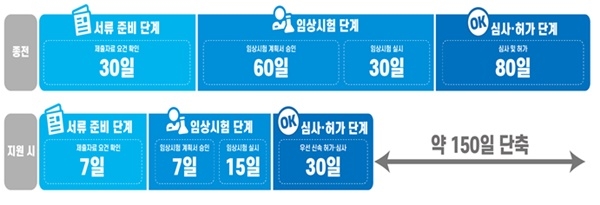
신청 준비단계에서는 허가도우미를 활용, 맞춤형 컨설팅을 지원해 허가 신청서류 준비기간을 기존 30일에서 7일로 단축한다.
임상 시험단계에서는 임상시험 가이드 제공과 계획서 신속 승인으로 임상시험 개발과 시험실시 기간을 90일에서 22일 이내로 단축한다. 심사·허가단계에서는 허가심사 가이드라인 제공과 우선 허가·심사대상 품목으로 선정으로 기간을 80일에서 30일로 줄인다.
이와 함께 K-방역모델 국제표준화로 세계 방역시장을 선도한다는 계획이다. 식약처는 관련 부처 및 민간전문가와 협력해 ‘감염병 진단기법’ 관련 표준 2종 및 ‘진단키트 긴급사용승인 절차’ 관련 표준 1종 등 K-방역모델의 국제표준 제정 작업을 추진 중이다.
‘유전자 증폭기반 진단기법’ 국제표준의 경우 지난 2월 국제표준화기구 의료기기 기술위원회(ISO/TC 212)에서 국제표준案(DIS)으로 승인됐으며, 각 회원국의 최종 승인절차를 거쳐 연내 국제 표준 제정이 완료될 것으로 전망하고 있다.
K-방역모델의 국제 표준화는 전 세계가 주목하는 우리의 진단검사 체계에 대한 신뢰도를 높이고, 한국의 코로나19 진단검사 정책과 기술을 배우길 희망하는 국가들에게 이를 공유하는 기회가 될 것으로 보인다.
진단시약 전주기 안전관리 정책도 추진한다.
식약처는 이달 1일부터 ‘체외진단의료기기법’이 시행됨에 따라 체외진단기기에 특성에 맞춘 전주기 안전관리체계를 도입하고, ▲맞춤형 안전관리체계 구축 ▲전문성 강화 ▲기술지원을 통한 체외진단의료기기 안전성·유효성 및 산업 경쟁력 확보를 위한 정책을 추진할 예정이다.
또 체외진단의료기기의 개발, 임상성능평가, 품질관리체계, 허가 및 제품화까지 전주기 안전관리 전담 조직 신설을 추진해 안전성이 확보된 우수한 품질의 진단시약이 신속하게 공급할 수 있는 체계를 구축한다.
포스트 코로나 시대를 맞아 진단제품 개발·연구도 지원한다.
우선 국내 진단시약의 품질향상과 임상평가 전문성을 제고한다는 방침이다. 품질관리에 필요한 표준품 제조‧관리‧분양, 국내외 기술정보, 최신 임상정보 등을 적기에 제공해 업계의 자체 품질 향상을 도모한다는 계획이다.
임상적 성능 시험 종사자는 전문교육을 이수하도록 하고, 체외진단 분야 핵심인재 양성을 위해 한국의료기기안전정보원의 규제과학전문가 교육과 연계해 인력 배출에 힘쓴다.
이어 코로나19 진단에 사용되는 유전자증폭장치, 핵산추출시약 등 주요 체외진단 제품의 국산화가 가능하도록 범부처 전주기 의료기기 연구사업을 통해 적극 지원할 예정이다.
식약처는 “코로나19와 같이 예상치 못한 신종 감염병 발생에 대응하여 진단시약 개발 연구를 적극 지원하고 K-방역 브랜드 가치의 국제적 위상을 지속 확산하기 위해 노력하겠다”며 “앞으로도 진단시약의 생산‧수급 상황을 꼼꼼히 모니터링하고, 국내 안정적 수급을 유지하면서 해외 수출‧지원에 힘쓰도록 하겠다”고 전했다.
suin92710@kukinews.com
































