우리 몸을 구성하는 DNA, 아미노산, 단백질 등은 자신의 거울상과 구조가 일치하지 않는 ‘카이랄성’을 갖는다.
때문에 동일한 화학식이라도 카이랄성이 다르면 물질과 생체 바이오시스템과의 상호작용이 크게 달라진다.
이런 ‘카이랄 선택성’은 생화학 및 의약학에서 널리 이용되지만, 지금까지 카이랄 관련 연구는 기술적 한계 때문에 의약품 연구 등 저분자 수준에 머물고 있었다.
종양 괴사시키는 카이랄 나노페인트 기술
KAIST 신소재공학과 염지현 교수팀이 바이오나노소재 표면에 카이랄성을 부여할 수 있는 ‘카이랄 나노페인트’ 기술을 세계 최초로 개발했다.
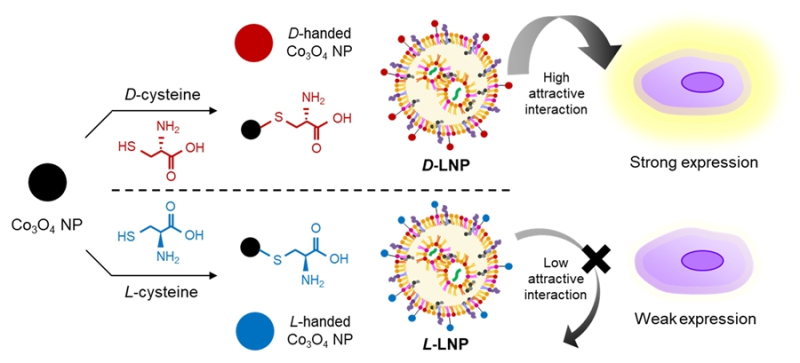
또 후속 연구로 생명과학과 정현정 교수팀이 mRNA를 전달하는 지질전달체 표면에 도입하는데 성공했다.
지질전달체(LNP)는 mRNA, 유전자, 약물 등 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자로, 코로나19 백신 이나 유전자 치료제에 중요한 역할을 한다.
염 교수팀은 카이랄성을 가진 분자들이 특정한 방식으로 작용하는 것을 활용, 왼손잡이(L-형)와 오른손잡이(D-형) 구조의 분자들이 서로 다르게 작용하는 카이랄 선택성에 주목하고 나노소재 표면에 ‘카이랄 나노페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다.
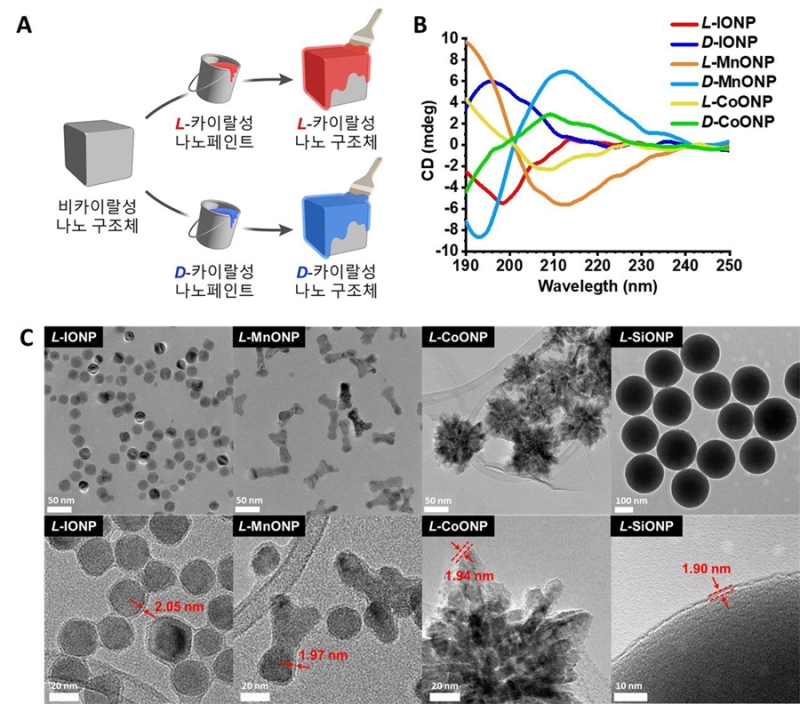
이 결과 십 ㎚ 크기 작은 입자부터 수 ㎛ 크기의 큰 구조체까지 다양한 크기의 소재에 카이랄성을 부여하는데 성공했다.
아울러 카이랄 나노페인트 기술을 활용해 카이랄 자성 나노입자를 합성, 이를 종양에 주입해 자기장 처리로 생성되는 열로 종양조직을 괴사시키는 항암 온열치료기술을 시연했다.
이 과정에서 D-카이랄성을 가진 자성 나노입자가 L-카이랄성을 가진 자성 나노입자보다 암세포에 더 많이 흡수되면서 4배 이상 향상된 항암 치료효과가 있음을 증명했다.
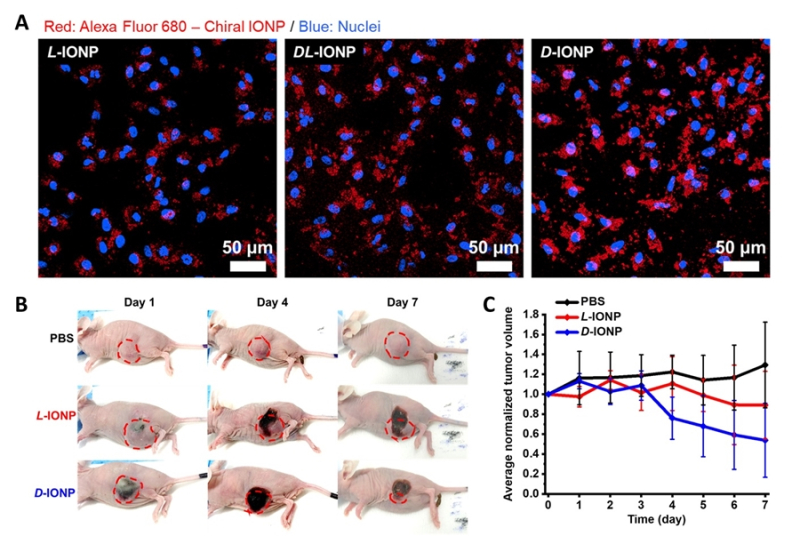
또 염 교수팀은 이 같은 암세포 내부 흡수효율 및 항암치료 효율 차이가 나노입자 표면에 처리된 카이랄 나노페인트와 세포 표면 수용체 간 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포실험으로 입증했다.
카이랄 나노페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물전달시스템, 바이오센서, 촉매 및 나노효소 등 다양한 분야에 응용될 것으로 기대된다.
이어 정 교수팀은 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입하는 후속 연구를 진행했다.
기존 mRNA 기반 치료제는 세포 내 단백질을 직접 합성할 수 있도록 유전정보를 전달하는 방식으로, 전달체의 불안정성으로 인해 치료효과가 제한적이었다.
정 교수팀 연구결과 D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
두 연구팀의 연구결과는 국제학술지 ‘에이씨에스 나노(ACS Nano)’ 지난 2일자 온라인에 게재됐다.
(논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460