DNA 염기서열의 변화 없이 유전자 기능이 바뀌어 후대에 유전되는 후성유전을 조절해 암이나 난치성 질환을 치료 혹은 예방할 수 있는 길이 열렸다.
한국생명공학연구원은 12일 김정애 유전체맞춤의료연구단 선임연구원을 필두로 한 연구원 연구팀과 김재훈 카이스트(KAIST) 교수 연구팀이 공동으로 히스톤 단백질의 화학적 변성을 조절하는 신규 작용 원리를 규명했다고 밝혔다.
후성유전의 핵심인자인 히스톤 단백질은 세포핵 내부를 구성하는 염기성 단백질의 하나로 DNA를 감싸며 유전자 발현을 조절한다. 이 중에서도 히스톤 꼬리의 화학적 변성에 따라 각기 다른 단백질의 생산을 유도해 DNA 복제에 핵심적인 역할을 하는 것으로 알려져 있다.
공동 연구진은 후성유전을 결정하는 대표인자로 DNA와 4종의 히스톤 단백질(H2A, H2B, H3, H4)로 이뤄진 핵산단백질 복합체인 거대분자 복합체인 ‘크로마틴(Chromatin)’의 화학적 변성이 세포분화와 개체 발생 및 다양한 질환의 진행과 밀접한 관련이 있다는 점에 착안해 연구를 시작했다.
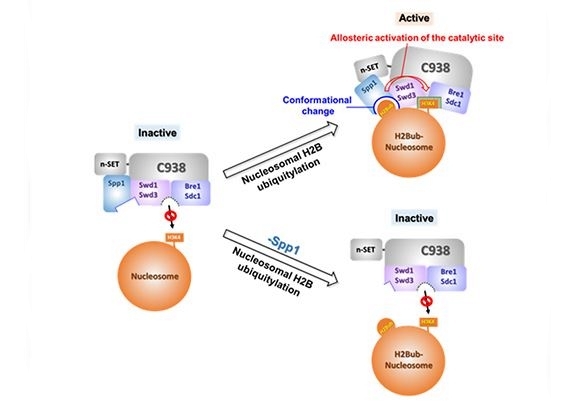
특히 크로마틴을 구성하는 히스톤 단백질 ‘H3’의 효소에 의한 촉매반응이 유전체의 발현, 유전체의 안정성 유지 및 재조합 조절 등 핵심적인 유전체 기능조절에 깊이 관여하고 있으며, H3의 비정상적인 변성이 질환 관련 유전자 발현의 이상을 일으켜 암과 같은 난치성 질환을 유발하거나, 항암치료 저항성을 야기하는 등의 악영향을 촉진할 수 있다는데 집중했다.
즉, DNA 편집과 같은 유전체의 안정성에 영향을 미치는 방식과 달리 유전체 변화 없이 히스톤 단백질의 화학적 변성만을 조절해 비정상적인 변화를 원상태로 되돌릴 수 있다면 비정상적 단백질의 생산을 제어해 세포분화 및 암을 포함한 난치성 질환을 치료하는 원천기술로 이어질 수 있을 것이라는 예상이다.
이에 연구팀은 세포로부터 직접 분리한 히스톤 단백질 H3의 촉매반응(메틸화)을 조절하는 효소와 생화학적으로 순수하게 재구성한 크로마틴을 이용해 세포 내에서 일어나는 히스톤 단백질 변성을 시험관 내에서 재현하고, 이를 분석해 히스톤 단백질의 작용원리를 규명했다.
이와 관련 연구팀은 “실험을 통해 히스톤 H3의 촉매반응이 효소의 구조적 변성에 의한 것이라는 분자적 원리를 밝힘으로써 이를 유도하거나 억제하는 물질의 개발을 통한 히스톤 단백질 변성을 조절할 수 있는 가능성을 확인했다”고 설명했다.
오준엽 기자 oz@kukinews.com
































