암세포가 증식과정에서 새로운 혈관을 만들면 주변이 저산소 환경으로 바뀌면서 정상세포의 사멸을 초래한다.
저산소 환경에 놓인 세포는 분자활성을 조절하며 특성을 변경하는 리프로그래밍(reprogramming)을 진행하는데, 이 과정에서 적응에 실패하며 손상을 입기 때문이다.
반면 암세포는 저산소 적응 리프로그래밍이 정상세포보다 더 활발하기 때문에 같은 환경에서도 생존확률이 높다.
국내 연구진이 이런 암세포의 저산소 적응력을 방해하는 핵심인자를 발견, 항암 신약개발에 활용할 수 있는 길을 제시했다.
저산소 암세포 사멸 유도인자 발견
한국생명공학연구원(이하 생명연)은 김정훈, 김정애 박사 연구팀이 저산소 환경에서 세포가 안정성을 유지하는 메커니즘을 규명했다고 27일 밝혔다.

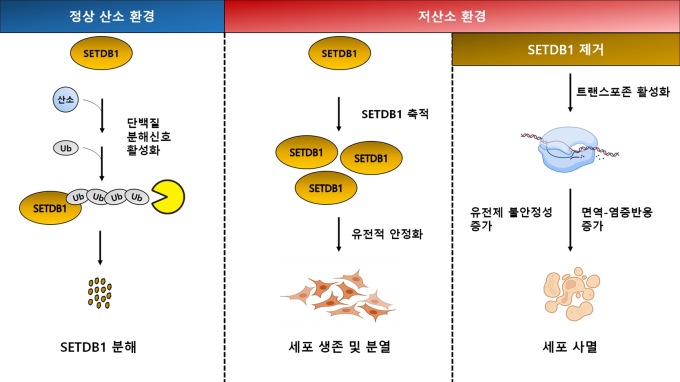
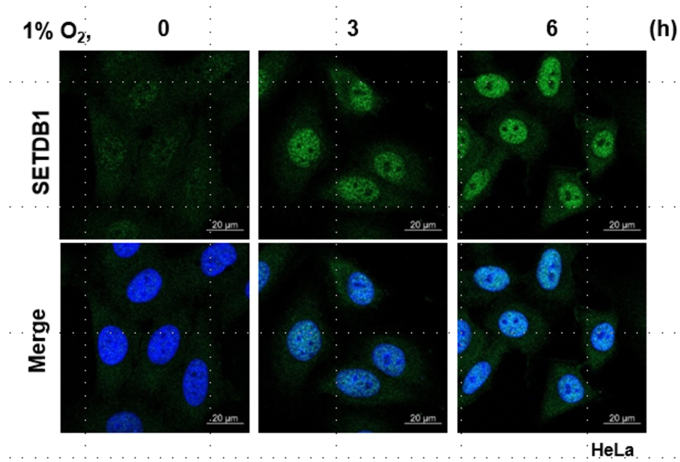
연구팀은 세포핵 내부에서 DNA를 감싸고 있는 히스톤 단백질이 산소 농도가 낮은 환경에서 변형되는 메틸화 현상에 주목했다.
이때 메틸화 효소로 작용한 것이 SETDB1 단백질.
SETDB1 단백질은 후성유전 조절인자로 세포의 항상성을 유지하는 작용을 하며, 다양한 암세포에서 과도하게 발현된 경우가 많은 것으로 알려졌다.
연구팀은 SETDB1 단백질이 정상적인 산소 환경에서 종양 억제 유전자인 VHL((Von Hippel-Lindau)과 결합해 세포 내에서 분해되는 현상을 발견했다.
하지만 산소농도가 낮아지면 VHL과의 결합이 약해지면서 SETDB1 단백질이 축적돼 유전체 안정화가 유지됨으로 세포의 생존성이 증가했다.
이에 따라 연구팀은 저산소 환경에서 SETDB1 단백질을 제거하면 유전체 불안정성이 증가하면서 비정상적인 유전자 발현, DNA 손상 등과 세포사멸을 유도할 수 있는 것을 확인했다.
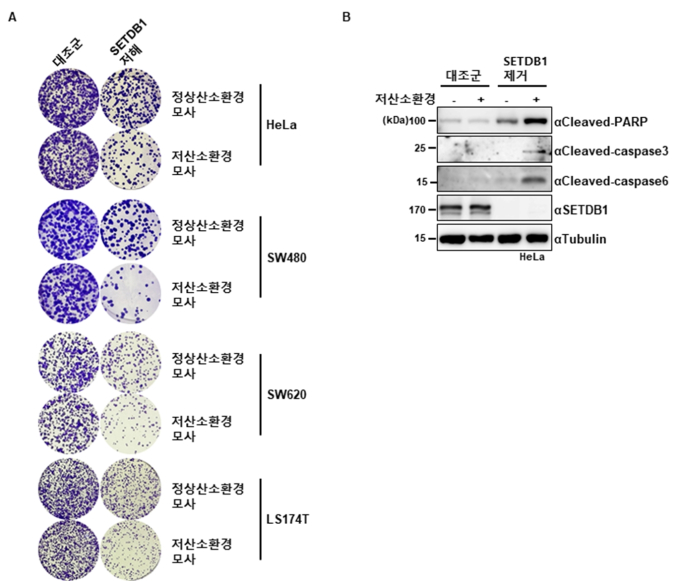
또 이를 토대로 암 환자 데이터를 분석해 SETDB1 단백질 발현과 면역-염증 신호 활성의 상관관계가 저산소 환경에서 더욱 뚜렷하게 나타나는 것을 발견하고, 저산소를 유도하는 암의 진행에 SETDB1 단백질이 연관된 사실을 밝혔다.
이 같은 연구결과는 향후 항암 신약개발에 활용될 가능성을 제시한 것으로 평가된다.
김정훈 박사는 “이번 연구는 암과 같은 저산소 적응성 질환을 효과적으로 제어할 수 있는 분자 표적을 찾은 것으로, 향후 SETDB1을 억제하는 혁신 신약개발에 활용될 수 있을 것으로 기대한다”고 밝혔다.
대덕특구=이재형 기자 jh@kukinews.com












































