기존 유전자 치료에 사용하는 바이러스 기반 전달방법은 면역 부작용, 발암성 등 한계점을 갖는다.
대신 비 바이러스성 단백질 기반 크리스퍼 전달은 본래 표적과 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 ‘오프타깃 효과’가 최소화돼 높은 안전성을 가져 치료제 개발에 적합하다.
하지만 크리스퍼 단백질은 분자량이 크기 때문에 전달체에 탑재하기 어렵고, 전달체의 세포독성과 표적세포로의 낮은 전달성이 문제였다.
이를 극복하기 위해 연구팀은 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합해 생체 내 본질적 생화학과정을 방해하지 않는 단백질을 개발, 기존 비 바이러스성 전달체의 문제를 해결하고 표적세포로의 전달성을 높였다.
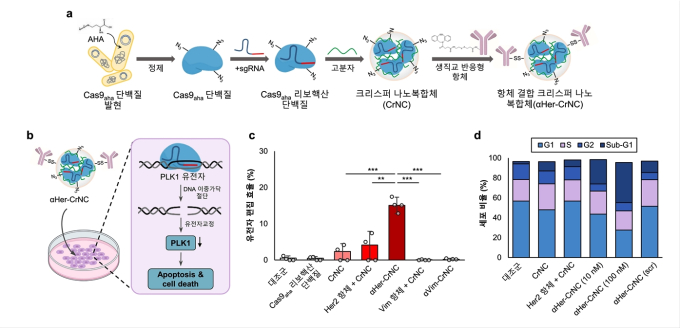
이를 통해 연구팀은 개량한 크리스퍼 단백질로 난소암 표적치료제를 위한 항체결합 크리스퍼 나노복합체를 개발했다.
암세포 표면은 종양 항원이 존재하고, 몇몇 종양 항원은 표적이 돼 진단 및 임상시험에 이용된다.
연구팀은 이번에 개발한 항체결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 항암효과가 높은 것을 검증했다.
특히 세포주기를 관장하고 암세포 분열과 관련 있는 PLK1 유전자를 표적해 암세포 분열을 억제하는 것을 확인했다.
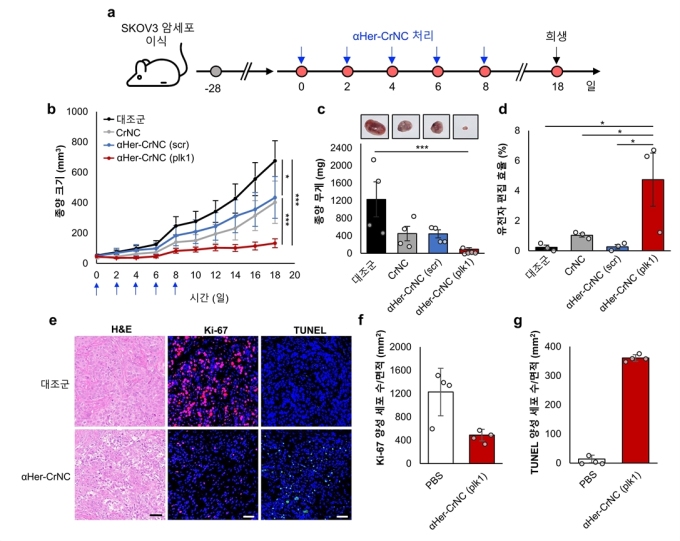
정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달과 항암 효능을 확인한 것이 큰 의의를 갖는다”며 “이번 연구를 기반으로 향후 생체 전신 투여를 통한 유전자 교정 치료와 다양한 암종에 적용할 수 있는 플랫폼 기술을 기대할 수 있다”고 말했다.
한편 이번 연구는 KAIST 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여했고, 연구결과는 국제학술지 `어드밴스드 사이언스' 3월 29일자 온라인판에 게재됐다.
대덕특구=이재형 기자 jh@kukinews.com