‘KRAS 단백질’은 췌장암, 폐암, 대장암 등 고형암의 주요 유발인자로, 지난 40년간 KRAS 유발 표적항암제 개발이 진행됐음에도 현재까지 만족할 만한 연구결과를 나오지 않고 있다.
KRAS는 돌연변이가 비정상적으로 활성화되면 세포 증식을 촉진하고 암세포 성장을 유도하는 대표적 발암성 유전자로, 전체 암의 20% 이상이 이와 관련된 것으로 알려졌다.
돌연변이가 발생하면 KRAS는 세포 증식과 밀접하게 관련된 하위 신호전달경로를 끊임없이 활성화시켜 암세포 증식이 촉진된다.
이 같은 돌연변이 발견은 폐암의 40%, 대장암의 50%나 되고, 췌장암은 무려 95%에 이른다.
특히 췌장암은 조기 발견율이 10% 이하로, 발병 후 5년 생존율이 가장 낮아 전이성 췌장암의 경우 5년 생존율이 2.1%에 불과하기 때문에 효과적이고 도전적인 치료법 개발이 절실하다.
발암 네트워크 차단 신약 기대
한국생명공학연구원(이하 생명연) 유전체맞춤의학연구센터 이동철 박사팀과 충남대 염영일 박사팀이 KRAS의 안정성을 높여 발암성을 지속하는 네트워크를 발견, 이를 통해 암 성장 과정을 제어할 수 있는 기술을 개발했다.
KRAS는 독특한 구조형태를 가진 탓에 돌연변이에 의한 비정상 활성을 억제하는 저해제 개발이 성과를 거두지 못하는 실정이다.
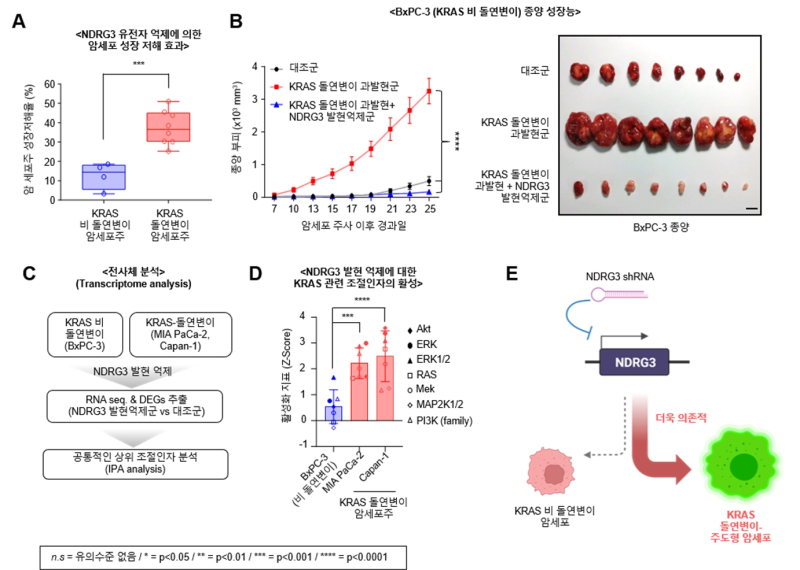
연구팀은 KRAS의 발현을 조절하는 새로운 네트워크를 발견, 이것이 KRAS 돌연변이로 유발되는 폐암, 췌장암 등 고형암 생성 및 발달에 매우 중요한 역할을 한다는 사실을 최초로 규명했다.
연구팀은 KRAS와 USP9X/NDRG3 단백질 간 형성된 네트워크를 차단하면 KRAS 단백질 분해를 유도. 돌연변이가 유발하는 췌장암 생성 및 성장이 억제되는 것을 암 세포주와 동물실험으로 확인했다.
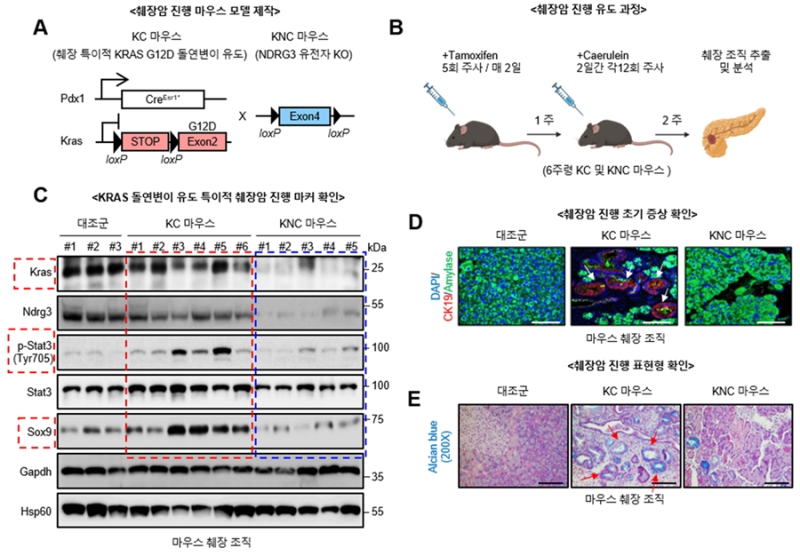
이 박사는 “돌연변이 KRAS 발현을 유지시키는 네트워크는 고형암 발병을 유도하고, 이 네트워크 형성을 차단하면 암 성장이 억제돼 새로운 항암제 개발을 위한 기술적 근거를 마련했다”며 “연구결과를 바탕으로 그동안 약물 개발이 어려운 KRAS 항암 효능을 가진 신약개발이 가능할 것으로 기대된다”고 설명했다.
한편, 이번 연구결과는 국제학술지 ‘Nature Communications’ 지난달 16일자 온라인에 게재됐다.
(논문명 : Anti-proteolytic regulation of KRAS by USP9X/NDRG3 in KRAS-driven cancer development)