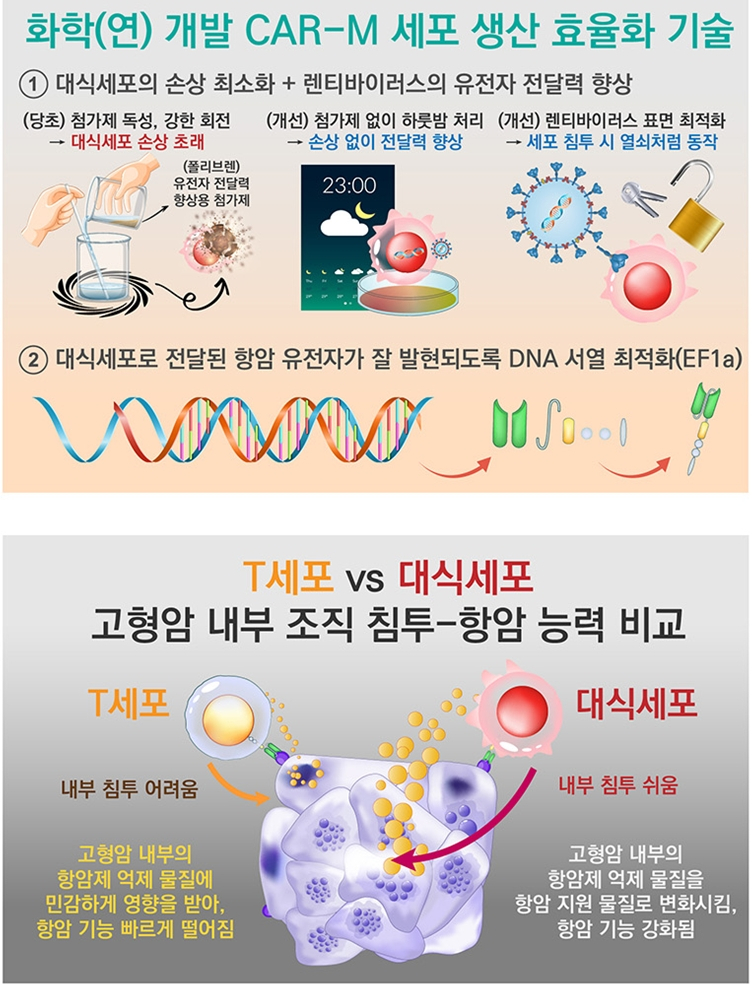
CAR-T 치료법은 환자의 면역세포인 T세포를 신체 밖으로 추출해 특정 암세포를 공격토록 유전자를 변형한 후 환자에게 주입하는 기술로, 백혈병 등 혈액암 치료에는 매우 효과적이지만 고형암에는 효과가 미미하다. 이는 T세포가 고형암 조직에 침투하는 것이 어렵기 때문이다.
대식세포는 고형암 조직 침투성이 우수한 면역세포로, 타겟 세포의 항원을 다른 면역세포에 제시해 공격하도록 유도한다. 이로 인해 CAR 대식세포는 CAR-T를 대체할 수 있는 유망한 유전자 세포치료제로 관심을 받고 있다.
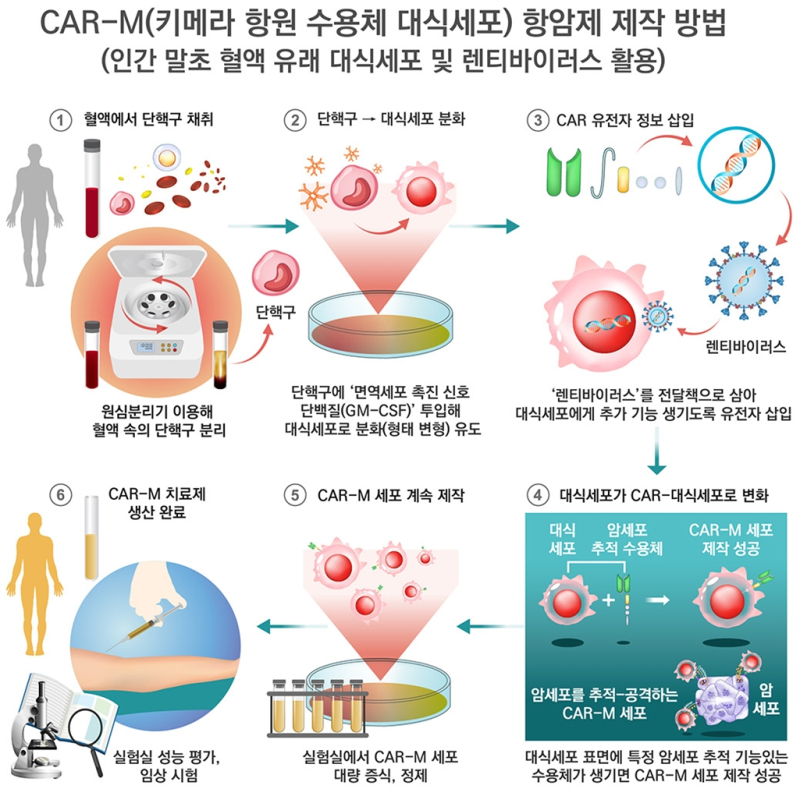
하지만 대식세포는 기존 방법으로는 렌티바이러스에 의한 유전자 전달이 까다롭기 때문에 글로벌 신약기업 ‘카리스마 테라퓨틱스(Carisma Therapeutics)’는 렌티바이러스 대신 아데노바이러스를 이용해 CAR 유전자를 대식세포에 전달하는 방법을 고안했디.
문제는 아데노바이러스로 유전자를 전달할 때 CAR 단백질 발현이 일시적이어 항암효과를 기대할 수 없는 것. 때문에 현재 시장에 출시된 모든 CAR-T 세포는 렌티바이러스를 이용한지만, 아직 인간 말초혈액 유래 대식세포를 대상으로 렌티바이러스를 이용해 CAR 대식세포를 제작한 사례는 없었다.
고형암도 잡는 만능 항암제
한국화학연구원(이하 화학연) 박지훈 박사팀이 기존 CAR-T 항암제를 보완할 수 있는 새로운 항암 기술의 실마리를 제시했다. 이 기술은 혈액암은 물론 고형암 치료에도 적용될 것으로 기대된다.
연구팀은 인간 말초혈액 유래 대식세포에 렌티바이러스를 이용한 항암 유전자를 안정적으로 삽입시킨 CAR-M 생산에 성공했다.
연구팀은 렌티바이러스를 유전자 전달책으로 삼아 대식세포의 손상 없이 항암 유전자를 효과적으로 전달하는 다양한 기술을 개발했다.
일반적으로 어떤 유전자를 렌티바이러스에 심어 다른 세포로 전달할 때 세포막을 얇게 만드는 양이온성 중합체 ‘폴리브렌’을 강하게 섞어 렌티바이러스의 세포침투 및 유전자 전달력을 높인다.
그러나 문제는 대식세포가 폴리브렌과 만나면 심각한 독성이 생기며 강한 회전 과정에서 구조가 손상되거나 생존율이 떨어진다.
연구팀은 폴리브렌 투입이나 강한 회전처리 대신 렌티바이러스와 대식세포의 접촉을 당초 1시간 30분에서 16시간으로 늘렸다. 그 결과 대식세포의 손상 없이 렌티바이러스의 전파가 기존보다 잘 일어났다.
아울러 연구팀은 대식세포 분화상태에 따라 유전자 전달효율이 변하는 것을 확인하고, 이를 감안해 말초혈액에서 얻은 단핵구가 대식세포로 분화되는 7일을 기다려 암세포 추적 유전자 전달률을 높였다.
또 렌티바이러스가 세포로 들어갈 때 표면에서 열쇠 역할을 하는 ‘VSV-G 단백질’의 코돈을 최적화해 유전자 전달력을 더욱 향상시키고, 렌티바이러스에 담겨 전달된 항암 유전자가 대식세포에서 잘 발현되도록 DNA 서열 ‘EF1a’를 찾아 적용시켰다.
그 결과 대식세포 손상 없이 유전자 전달 후 최대 20일 동안 안정적으로 항암 기능을 갖춘 ‘CAR 대식세포’ 생산을 유지했다.
실제 급성 림프구성 백혈병과 B세포 림프종의 대표 세포주인 Nalm6와 Raji 암세포를 대상으로 붉은색 형광단백질을 발현시킨 후, 전자 현미경으로 5일 뒤 확인했을 때 붉은색 부분이 현저히 줄어 CAR 대식세포가 대부분의 암세포를 파괴했음을 확인했다.

연구팀은 후속 연구를 통해 CAR 대식세포의 대량생산 및 고효율 치료 적용 기술을 개발할 계획이다.
박 박사는 “CAR 대식세포는 CAR-T cell이 효과를 보이지 못하는 고형암 치료를 해결해 줄 수 있다”며 “이번 연구는 말초 혈액에서 얻은 대식세포의 낮은 항암 유전자 발현을 렌티바이러스로 개선한 최초 사례”라고 설명했다.
이영국 화학연 원장은 “기존 CAR-T 세포 치료법을 보완해 면역항암 치료 다각화에 기여할 것”이라고 말했다.
한편, 이번 연구는 최지우 석사후연구원이 제1저자로 참여했고, 연구결과는 국제학술지 ‘생체신호연구(Biomarker Research)’ 지난 1월호에 게재됐다.