[쿠키뉴스=조민규 기자] 식품의약품안전처(처장 손문기) 식품의약품안전평가원은 3D 프린터를 이용해 제조되는 의료기기가 신속하게 제품화될 수 있도록 정형용 임플란트와 치과용임플란트고정체에 대한 품목별 가이드라인을 마련해 10월21일 제공한다고 밝혔다.
‘정형용임플란트’는 두개골성형재료, 인공관절, 인공광대뼈 등과 같은 인공뼈를 대체하거나 재건하는 데에 사용하는 의료기기를 말한다. ‘치과용임플란트고정체’는 환자의 저작 기능 회복을 위해 인공치아 등 보철물을 지지하기 위해 입안에 삽입하는 나사모양의 의료기기이다.
이번 가이드라인 개발은 지난 5월18일 박근혜 대통령 주재로 개최된 제5차 규제장관회의에서 신산업 규제혁신 발굴과제에 대한 후속조치로 국내 3D 프린팅 의료기기 제품화 연구개발을 선제적으로 지원하기 위한 것이다.
3D 프린팅 의료기기는 환자별로 맞춤형, 소량 생산이 가능한 제품으로, 제품 개발을 위해서는 품목 특성별 안전성과 성능 평가 방법, 시험규격 등의 세부 기준이 필요하다.
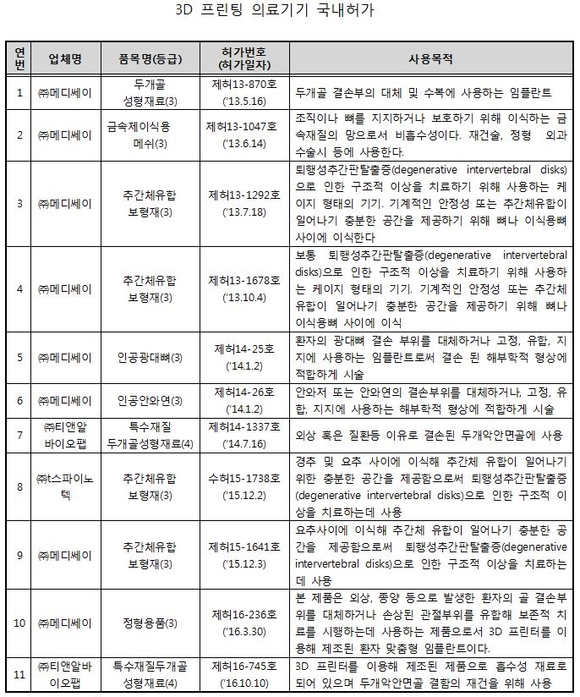 현재 국내에서 허가‧신고된 3D 프린팅 의료기기는 광대뼈나 두개골 결손부위에 사용하는 정형용임플란트 및 이러한 임플란트 등의 수술시 수술부위를 표시‧안내하기 위한 수술용 가이드 등 10개사, 18개 제품이다.
현재 국내에서 허가‧신고된 3D 프린팅 의료기기는 광대뼈나 두개골 결손부위에 사용하는 정형용임플란트 및 이러한 임플란트 등의 수술시 수술부위를 표시‧안내하기 위한 수술용 가이드 등 10개사, 18개 제품이다.
이번 가이드라인은 인공무릎관절, 인공엉덩이관절 등 정형용임플란트와 치과용임플란트고정체를 제조하는 업체들이 해당 제품에 대한 안전성과 성능을 확보할 수 있도록 시험항목, 시험방법 등 제품 개발 시 고려해야 할 사항을 안내하기 위해 마련했다.
주요 내용은 정형용임플란트와 치과용임플란트고정체 각각에 대한 ▲시험규격 설정 시 고려해야 할 사항 ▲생물학적 안전과 성능에 대한 시험항목 및 평가시험자료 ▲물리‧화학적 특성에 대한 평가 항목, 시험방법 등이다. 이번 가이드라인 발간 이후에도 인공연골, 인공혈관‧인공피부에 대한 가이드라인을 각각 마련해 오는 11월 제공할 예정이다.
지난해 12월 식약처는 3D 프린팅 의료기기 개발에 공통적으로 적용할 수 있는 ‘3D 프린터를 이용해 제조되는 맞춤형 의료기기 허가심사 가이드라인’을 마련한 바 있다.
식약처는 앞으로도 3D 프린팅 의료기기에 대한 연구‧개발부터 제품화에 이르기까지 선제적 지원을 통해 3D 프린팅 의료기기의 경쟁력을 확보하는 동시에 신속하게 제품화될 수 있도록 최선을 다하겠다고 밝혔다.



































