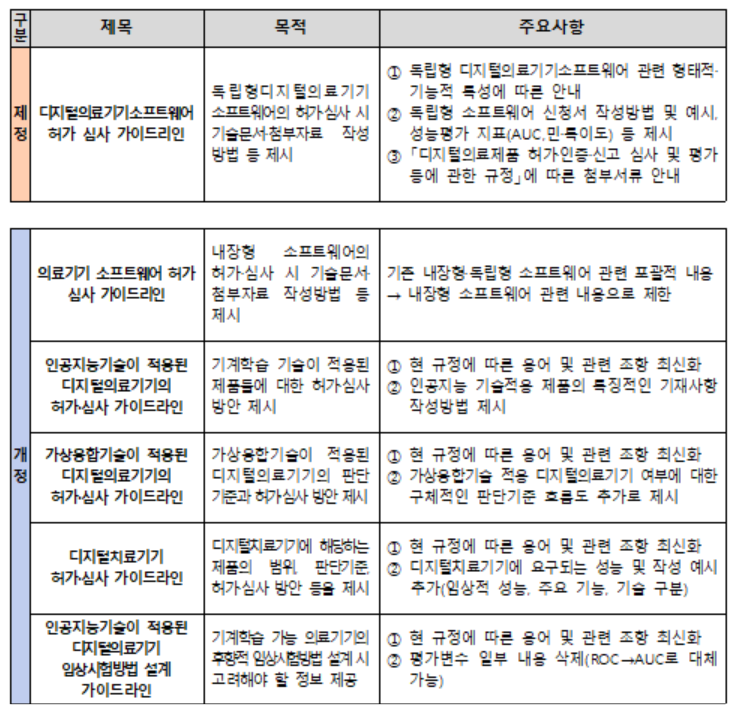
식품의약품안전처 식품의약품안전평가원은 ‘디지털의료제품법’ 하위 규정 시행에 따라 디지털의료기기 관련 가이드라인 1종을 제정하고 5종을 개정했다고 7일 밝혔다.
이에 따라 디지털 의료기기 소프트웨어의 특성을 반영한 허가 신청서 및 첨부서류 작성 방법을 안내한다. 또 인공지능·가상융합기술 등이 적용된 디지털 의료기기에 대해 △제품 분류 판단 기준과 흐름도 정비 △기술별 제품 사례 안내 △허가 제출자료의 범위 정비 등이 이뤄진다.
식약처는 “업계의 디지털의료제품 허가·심사 절차에 대한 이해도를 높여 안전한 디지털의료기기가 공급되는 데 도움이 될 수 있기를 기대한다”며 “전문성과 규제과학을 기반으로 디지털의료기기 개발을 체계적으로 지원할 계획”이라고 전했다.
제·개정된 가이드라인 전문은 식약처 대표 누리집의 공무원지침서·민원인안내서에서 확인할 수 있다.