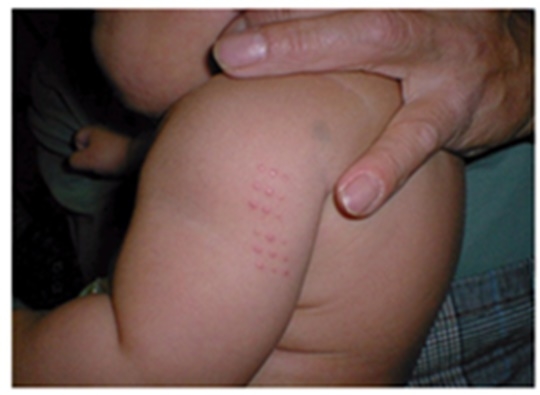
비소 검출 경피용 BCG 백신 논란이 계속되고 있는 가운데 보건당국의 수입 백신 관리에 허점이 있었던 것으로 드러났다. 모든 백신은 ‘국가출하승인’ 대상인데, 이번에 비소가 검출된 첨부용제는 검사 대상에서 제외된 것이다. 보건당국과 수입업체는 일본 후생노동성 발표 전까지 백신 문제를 인지하지 못했던 것으로 나타났다.
국가출인승인은 백신이 시장에 유통되기 전 국가가 자료검토와 검정 등을 걸쳐 출하를 승인해주는 절차다. 백신은 살아있는 생물에서 생산되기 때문에 제조할 때마다 품질이 다를 수 있어 국가에서 한 번 더 품질을 확인하는 것이다.
그런데 이번에 비소가 검출된 첨부용제 생리식염수는 검사 대상에서 제외된다. 백신에는 주성분 백신 균주, 접종하는 과정에서 쓰이는 첨부용제(식염수), 주사기가 한 세트이지만, 첨부용제는 제조 수입사의 품질관리성적을 기준으로만 안전성을 판단한다. 이는 전 세계 공통이라는 것이 식약처 설명이다.
식약처는 “수입업체인 한국백신도 우리와 비슷한 시기, 이달 초에 사실을 파악했다. 이 문제가 생긴 이유는 일본 보건당국에서 비소 검출 여부를 말하지 않아서다”라며 “아마 후생성은 안전성 문제가 없다고 판단해서 발표를 하지 않았던 것으로 보인다”고 말했다.
후생노동성은 지난 8월 9일 백신 제조업자인 ‘일본 BCG제조'로부터 BCG 백신 첨부용액에서 기준치를 넘는 비소가 검출됐다는 보고를 받고 제품 출하를 중단시켰다. 그러나 ’비소량이 매우 적어 안전성에 문제가 없으며, 문제 제품의 대체품이 없다'는 이유로 회수하지 않았고, 바로 공표하지 않은 것이 이달 초에야 언론을 통해 밝혀졌다.
전문가들에 따르면 백신에서 검출된 비소량은 0.039㎍ 정도고, 1일 허용 기준치랑 비교했을 때 1/38 정도 수준이어서 안전성 문제는 적다. 그러나 생후 4주 이내에 맞게 되어있는 신생아 대상 결핵 백신인 만큼 부모들의 걱정과 분노는 식지 않고 있다.
식약처는 “이번 회수조치는 품질 기준 위반 및 국민불안감 해소 차원이며, 첨부용액에 함유된 비소의 안전성 문제로 인한 것이 아니다”라며 “식약처는 일본의 검사결과와 별개로 자체적인 검사를 실시하고 있으며, 제조(수입)사의 품질관리를 통해 검증하던 ‘첨부용제’도 향후 품질검사방안을 적극 마련할 계획이다”라고 밝혔다.
유수인 기자 suin92710@kukinews.com