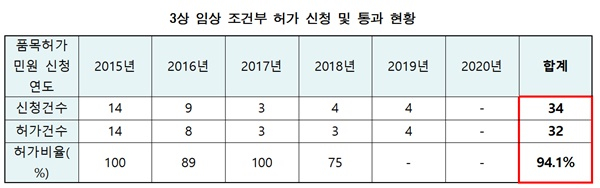
[쿠키뉴스] 유수인 기자 = 지난 5년간 조건부 허가된 의약품 32개 중 8개는 현재시점으로 생산실적이 전혀 없는 것으로 나타났다.
국회 보건복지위원회 국민의힘 백종헌 의원은 13일 식품의약품안전처 국정감사에서 “2015년 이후 식약처가 급하다고 허가 내준 조건부 허가 의약품은 32개였으며, 이 중 25%는 생산실적이 전혀 없는 것으로 드러났다”면서 “또 국산신약 개발을 독려하기 위해 신속심사제도를 마련됐지만 조건부 품목 32개 품목 중 국산 신약은 단 3개뿐으로 조사됐다”고 지적했다.
3상 조건부허가는 생명을 위협하는 질병,현존하는 치료법으로는 치료가 불가능한 경우(항암제, 희귀의약품 등) 환자들에게 신속한 치료기회를 제공하기 위해 마련된 제도다. 식약처 심사요건 충족시, 시판후 확증 임상시험 자료 제출을 조건으로 허가한다.
그러나 32개 의약품 중 1개 제품은 허가 이후 생산이 전혀 되지 않았고, 5개 제품은 올해 시점에서 생산이 전혀 되지 않았다. 2개 의약품은 생산이 전혀 없었고 자진취소를 해버린 것으로 확인됐다.
특히 지난 2008년 신설된 ‘의약품의 품목허가·신고·심사 규정’ 제58조에 따라 국내 개발 신약, 개량신약은 우선해 심사토록 했지만, 조건부 품목 32개 품목 중 국산 신약은 단 3개였다.
이에 이의경 식약처장은 “조건부허가 품목의 생산실적이 낮은 이유는 치료 대상인 희귀질환자 수가 적고 약가가 결정되는 절차가 지연되는 경우가 많기 때문”이라고 설명했다.
그러면서 “국내 개발 신약이 저조하긴 하지만, 당초 조건부허가 제도 취지는 환자들의 치료기회를 확대하기 위한 것”이라고 덧붙였다.
suin92710@kukinews.comㅅ



































