 세계적으로 첨단바이오의약품 개발 투자가 증가하고 있는 가운데 국내 연구개발사들이 해외협력으로 공동연구와 라이센싱/기술이전에 관심이 많은 것으로 나타났다.
세계적으로 첨단바이오의약품 개발 투자가 증가하고 있는 가운데 국내 연구개발사들이 해외협력으로 공동연구와 라이센싱/기술이전에 관심이 많은 것으로 나타났다.
‘글로벌 첨단바이오의약품 관련 산업백서’에 따르면 글로벌 줄기세포치료제 시장은 2013년 400억달러에서 2018년 1177억달러 규모로 성장이 전망됐다. 줄기세포치료제 및 치료기술 관련 임상시험의 증가, 줄기세포은행 서비스 산업 활성화 등이 산업성장을 이끌 것이라는 분석이다.
줄기세포치료제의 국가별 임상연구 현황을 보면 1999년부터 2016년 사이에 수행된 총 분석대상 임상 314건 중 한국은 총 46건(15%)을 등록해 155건(49%)을 등록한 미국에 이어 세계 2번째로 많은 임상을 실시한 것으로 나타났다.
2016년의 경우 신규 임상연구는 미국이 23건으로 가장 많이 등록했으며, 이어 중국(8건), 한국(5건), 대만(3건)의 순이었다. 스페인과 이스라엘도 각각 2건의 임상을 신규 등록했다.
유전자치료제의 경우 글로벌 시장은 연평균 12% 성장해 2020년 경에는 5억불의 시장을 형성할 것으로 예측(시장분석기관 Kuick Research)됐다. 현재 일부 국가에서 자체 승인된 유전자치료제를 포함하면 10건이 허가됐는데 중국·필리핀·러시아 등 일부는 자국내에서 한정적으로 상용화했지만 글로벌 치료제로서는 인정받지 못한 상황이다.
유전자치료제의 국가별 임상연구 현황을 보면 535건으로 미국이 전체대비 53%(284건)로 가장 많았고, 이어 영국 6%(34건), 프랑스 5%(26건), 중국 3%(16건), 한국 2%(11건) 순이었다.
첨단바이오의약품(줄기세포치료제, 유전자치료제)을 연구 개발 중인 24개 국내기업을 대상으로 실태조사를 진행한 결과, 국내 주요 첨단바이오의약품 연구개발 중심 기업 중 주요 12개사가 연구개발 중인 줄기세포치료제 파이프라인은 총 37개로 업체당 평균 3.1개를 보유하고 있는 것으로 나타났다.
또 임상시험단계(1~3상) 파이프라인은 18건(48.6%), 전임상단계(IND) 파이프라인은 11건(29.7%)으로 77.3%가 개발이 완료됐거나 개발단계에 있는 등 본격 실용화 단계에 있었다.
유전자치료제 파이프라인은 주요 12개사가 총 35개를 연구개발 중인데 이는 업체당 평균 2.9개에 해당된다. 이중 허가 완료에 있는 유전자치료제는 1건, 임상단계는 8건(22.9%), 전임상단계 11건(31.4%) 등 총 20건의 유전자치료제 파이프라인이 개발완료를 앞두고 있거나 개발단계에 진입해 실용화 연구가 진행 중으로 나타났다.
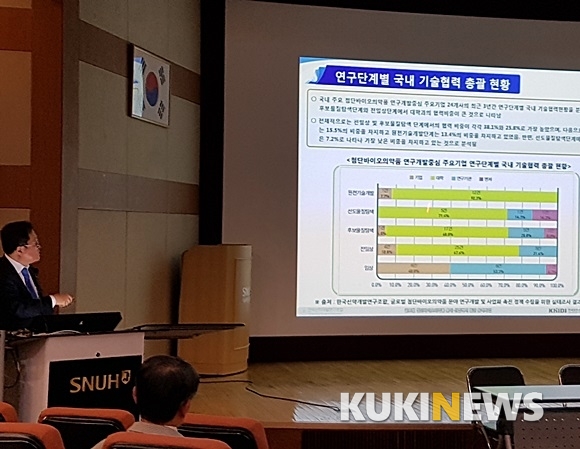
전체적으로는 전임상 및 후보물질 탐색 단계에서의 협력 비중이 각각 38.1%와 25.8%로 가장 높았고, 이어 임상단계(15.5%), 원천기술개발단계(13.4%), 선도물질탐색단계 협력(7.2%) 순이었다.
국내 첨단바이오의약품 연구개발 중심 주요기업 24개사의 최근 3년간 국내 협력기관과의 기술협력 분포를 분석한 결과 대학이 전체 94건 가운데 48건(51.1%)으로 나타나 가장 높았다. 연구개발 협력 유형으로는 공동연구가 80건(85.1%)으로 대부분을 차지했고, 라이센싱/기술이전(13건, 13.8%)이 뒤를 이었다.

또 이들 기업의 최근 3년간 연구단계별 국내 기술협력 현황을 분석한 결과 후보물질탐색단계(25.8%)와 전임상단계(38.1%)에서 대학과의 협력비중이 큰 것으로 나타났다. 이어 임상단계(15.5%), 원천기술개발단계(13.4%)로 나타났다. 반면 선도물질탐색단계에서의 협력은 7.2%로 가장 낮았다.
이들 기업이 향후 희망하는 국내 기술협력 유형으로는 공동연구와 라이센싱/기술이전, 위탁연구에 높은 수요를 보였다. 공동연구의 경우 주로 대학과의 기술협력 수요가 높았고, 라이센싱/기술이전의 경우는 동종기업·대학·벤처 등 기관유형에 관계없이 파트너쉽을 희망하고 있는 것으로 나타났다.
글로벌 협력현황을 보면 해외 10개국 기업, 대학, 벤처, 연구기관 등과 총 57건의 협력활동을 전개한 것으로 나타났다. 국가별로는 미국이 40건(70.2%)으로 가장 많았고, 이어 중국(4건), 캐나다(3건), 순이었다. 또 이들 회사의 절반 이상은 연구기관과 협력했고, 대부분 공동연구를 진행한 것으로 나타났다.
국내 주요 첨단바이오의약품 연구개발 중심 기업들이 보유하고 있는 줄기세포 및 유전자치료제의 글로벌 라이센싱-아웃 희망 품목을 분석한 결과 24개 회신기업 중 12개사가 28개 품목(기업당 평균 2.3개)에 대해 희망하는 것으로 나타났다.
글로벌 라이센싱-아웃 희망 품목 가운데 유전자치료제가 총 15건(53.6%), 줄기세포치료제는 13건으로 나타났다. 희망국가 선호도는 미국 25개, 유럽 18개, 일본 10개, 중국 5개, 중남미 5개, 순으로 선진국(미국, 유럽) 시장과 동아시아(중국, 일본), 중남미 지역을 선호하는 모습을 보였다.
한편 한국신약개발연구조합이 첨단바이오의약품의 R&D파이프라인 연구개발시 중단해야 하는 상황이 발생하는 경우를 가정해 연구중단에 대한 주요 원인을 조사한 결과 효능성 부족, 재원부족, 안전성 부족 순으로 높았다. 반면 정부의 규제는 상대적으로 우선순위가 낮게 나타났다.
또 첨단바이오의약품 분야의 제도개선 및 R&D 투자 관련 개선과제로는 ‘건강보험 급여 적용 개선’이 가장 시급한 것으로 나타났고, 이어 ▲기존 연구성과 활용 및 전략적 R&D 지원 ▲인허가 제도개선 ▲생명윤리 및 임상 관련 규제 개선 등의 순으로 나타났다.
정부의 지원이 필요한 중점 기술분야에 대해서는 줄기세포치료제의 경우 ▲기능조절 물질 발굴 및 최적화 기술 ▲효능 및 안전성 평가 ▲타깃발굴 ▲제조기술 ▲이식기술 ▲분리기술 ▲모니터링기술 순으로 나타났다. 유전자치료제에서는 ▲전달물질/ 벡터 제작기술 ▲치료유전자발굴 및 최적화 기술 ▲타깃발굴 ▲제조기술 ▲효능 및 안전성평가 ▲생체전달 모티터링기술 등의 순이었다.
조민규 기자 kioo@kukinews.com
 세계적으로 첨단바이오의약품 개발 투자가 증가하고 있는 가운데 국내 연구개발사들이 해외협력으로 공동연구와 라이센싱/기술이전에 관심이 많은 것으로 나타났다.
세계적으로 첨단바이오의약품 개발 투자가 증가하고 있는 가운데 국내 연구개발사들이 해외협력으로 공동연구와 라이센싱/기술이전에 관심이 많은 것으로 나타났다. 또 이들 기업의 최근 3년간 연구단계별 국내 기술협력 현황을 분석한 결과 후보물질탐색단계(25.8%)와 전임상단계(38.1%)에서 대학과의 협력비중이 큰 것으로 나타났다. 이어 임상단계(15.5%), 원천기술개발단계(13.4%)로 나타났다. 반면 선도물질탐색단계에서의 협력은 7.2%로 가장 낮았다.
또 이들 기업의 최근 3년간 연구단계별 국내 기술협력 현황을 분석한 결과 후보물질탐색단계(25.8%)와 전임상단계(38.1%)에서 대학과의 협력비중이 큰 것으로 나타났다. 이어 임상단계(15.5%), 원천기술개발단계(13.4%)로 나타났다. 반면 선도물질탐색단계에서의 협력은 7.2%로 가장 낮았다.





































