희귀의약품의 경우 임상시험계획 승인만으로도 희귀의약품 지정이 가능하도록 제도가 개선된다. 희귀의약품은 적용대상이 드물고 적절한 대체의약품이 없어 긴급한 도입이 필요한 의약품을 말한다.
식품의약품안전처(이하 식약처)는 희귀‧난치 질환치료제의 신속한 개발을 지원하기 위해 희귀의약품의 경우 임상시험계획 승인만으로도 희귀의약품 지정이 가능하도록 제도를 개선하는 것을 주요 내용으로 하는 ‘희귀의약품 지정에 관한 규정’ 개정안을 행정예고했다고 18일 밝혔다.
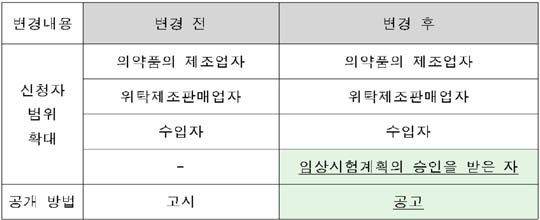
개선안의 주요 내용은 ▲희귀의약품 지정 신청자 범위 확대 ▲희귀의약품 지정 절차 변경을 통한 공개방법 개선 등이다.
그동안 의약품 제조업‧위탁제조판매업‧수입자만 희귀의약품으로 지정받아 제품을 개발할 수 있었으나, 앞으로는 임상시험 계획을 승인 받은 경우에도 신청이 가능하게 된다.
또 희귀의약품은 행정예고 등을 거쳐 지정했었으나, 앞으로는 식약처 홈페이지를 통해 공고함으로써 지정 기간이 단축된다.
식약처는 “이번 개정안을 통해 희귀의약품의 개발·공급 확대에 도움이 될 것”이라며 “앞으로도 희귀‧난치질환자의 치료 기회 보장을 위해 정책적 지원을 지속해 나겠다”고 밝혔다.
유수인 기자 suin92710@kukinews.com






































