환자들에게 치료제를 신속히 사용할 수 있도록 돕는 3상 조건부 허가제도가 이슈몰이에 그치고 있다는 지적이다.
3상 조건부 허가는 생명을 위협하는 질병, 현존하는 치료법으로는 치료가 불가능한 경우(항암제, 희귀의약품 등) 환자들에게 신속한 치료기회의 제공을 목적으로 식약처 심사요건 충족시, 시판후 확증 임상시험 자료 제출을 조건으로 하는 허가제도이다.
민주평화당 장정숙 의원(국회 보건복지위원회)이 식품의약품안전처(이하 식약처)로부터 제출받은 최근 3년간 3상 임상 조건부 허가 신청 및 통과 현황을 분석한 결과, 총 23건 중 2건을 제외한 21건(91.3%)이 허가된 것으로 나타났다.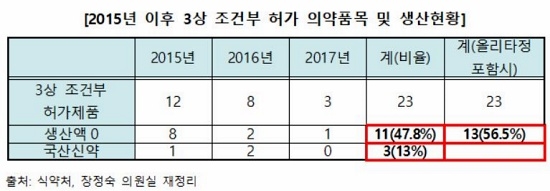
특히 이 중 11개(47.8%)가 현재시점으로 생산실적이 전혀 없는 것으로 드러났고, 여기에 페암 치료제로 주목받았던 A의약품(2종)도 올해 4월13일 개발 중단 계획서 제출했기 때문에 23개 중 13개(56.5%)의 의약품이 생산·공급을 하지 않고 있는 것으로 확인됐다.
13개 의약품 중 허가 이후 생산이 전혀 되지 않는 의약품은 5개, 2018년도 현재시점에서 생산이 전혀 되지 않는 의약품은 4개, 생산이 전혀 없었고 자진취소 한 의약품은 2개 등이다.
더욱이 국산신약 개발을 독려하기 위해 마련한 제도라고 하지만 23개 품목 중 국산 신약은 단 3개(13%)에 불과했다.
장정숙 의원은 “환자 치료 때문에 허가를 빨리 내주는 특혜를 주는 것인데 제약회사가 허가를 받고도 환자들에게 치료제를 공급하지 않는다면 ‘조건부 허가제’의 의미는 퇴색된다”며 “식약처는 허가 전 수요조사, 시판 후 공급계획, 사후 조건충족 여부 전반에 대해 사전조사를 하고, 생산이 없는 제품은 과감히 정비해야 해야 한다”라고 밝혔다.
조민규 기자 kioo@kukinews.com

































