실명을 유발하는 선천망막질환을 유전자교정을 통해 완전히 치료하는 길을 국내 의료진이 열었다.
서울대학교병원 안과 김정훈 교수팀과 ㈜툴젠 연구팀은 레버선천흑암시를 지닌 생쥐에게 유전자교정물질을 전달해 유전자 돌연변이를 완전히 교정하는데 성공했다고 31일 밝혔다.
레버선천흑암시란 시각기능과 관련된 유전자(RPE65, CEP290 등)의 돌연변이로 인해 발생하는 대표적인 선천망막질환이다. 출생 시 선천적 실명을 일으킬 수 있는 유전성 망막 이상으로, 시각장애 특수학교 어린이 10~18%가 해당 질병을 앓고 있다.
연구팀은 돌연변이RPE65 유전자를 가진 rd12생쥐의 망막하 공간에 크리스퍼 유전자가위와 정상RPE65 유전자를 탑재한 아데노연관바이러스 벡터를 주사했다.
그 결과, rd12생쥐의 망막색소상피세포에 정상RPE65 단백질이 합성됐다. 치료 후 6주, 7개월 뒤 시행된 두 차례의 망막전위도검사에서도 rd12생쥐의 시각반응은 정상적인 생쥐의 20% 수준으로 높아졌고, 망막신경세포층의 두께도 회복됐다.
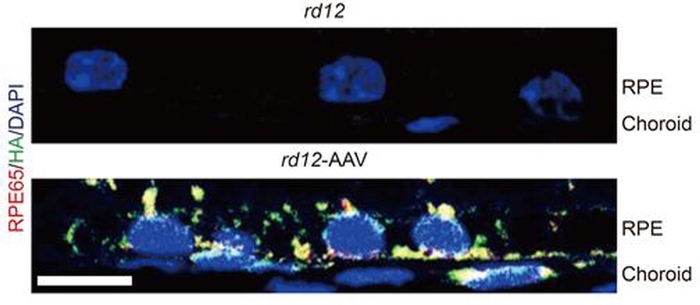
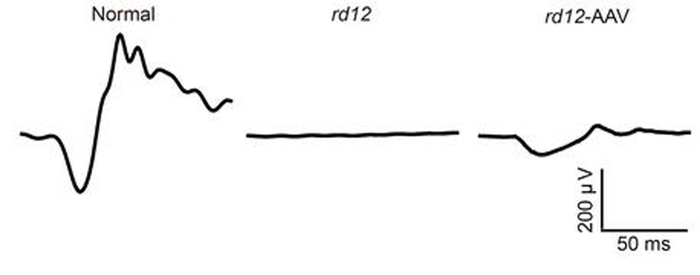
이번 연구의 의의는 크게 두 가지이다. 첫째로, 유전자 돌연변이를 완전히 교정했다는 점이다. 아데노연관바이러스 유전자 치료제를 주입하는 방법은 이미 레버선천흑암시 환자치료에 활용하고 있다. 다만 주입 후에도 돌연변이 유전자가 세포 내에 그대로 존재한다는 한계가 있었다. 환자가 명확한 치료를 받지 못한 채 실명에 이르는 경우가 많았던 것이다.
그런데 이번 연구에서 크리스퍼 유전자가위를 활용해 돌연변이 유전자를 완전히 교정할 수 있다는 것을 증명했다. 레버선천흑암시를 비롯한 선천망막질환을 더 근본적으로 치료할 수 있는 가능성이 열린 셈이다.
둘째로, 이번 연구에선 비표적 효과로 인한 부작용이 없었다. 비표적 효과란 쉽게 말해 원래 목표가 아닌 엉뚱한 유전자를 인식해 발생하는 현상이다. 이번 연구에서 비표적 효과가 나타난 부위는 전체 DNA중 10개 미만으로 아주 적었으며, 7개월 뒤 시행된 조직 검사에서도 아무런 이상이 없는 것으로 나타나, 치료의 안전성을 시사했다.
서울대병원 안과 김정훈 교수는 “이번 연구는 선천망막질환에서 원인이 되는 유전자 돌연변이를 완전히 교정할 수 있는 가능성을 확인했다”며 “이 연구는 실제 임상 치료제 개발의 발판이 될 것”이라고 기대했다.
이 연구는 저명한 국제학술지 ‘사이언스’ 자매지인 ‘사이언스 어드밴시스’ 최신호에 게재됐다.
전미옥 기자 romeok@kukinews.com

































