 [쿠키뉴스=조민규 기자] 지난해 차세대 항암제로 떠오르고 있는 면역항암제의 임상승인이 154건에 달하는 것으로 나타났다. 이는 항암제 전체 임상시험의 76%에 달한다.
[쿠키뉴스=조민규 기자] 지난해 차세대 항암제로 떠오르고 있는 면역항암제의 임상승인이 154건에 달하는 것으로 나타났다. 이는 항암제 전체 임상시험의 76%에 달한다.
식품의약품안전처가 발표한 2016년 임상시험계획 승인 현황을 분석한 결과, ▲전체 임상시험 승인 건수 감소 ▲바이오의약품 임상시험 증가 ▲제약사임상시험 승인건수 감소 ▲연구자임상시험 증가 ▲효능군 중 항암제 승인건수 최다 등의 특징이 있었다.
임상시험을 효능군 별로 살펴보면 항암제가 2015년(254건)에 비해 줄어들었지만 202건으로 가장 많았다. 이어 항생제(55건), 중추신경계(51건), 심혈관계(50건) 등의 순이었다.
항암제 중 표적항암제나 인체면역기전 활성화를 통해 암세포를 죽이는 면역항암제의 임상승인 건수는 2014년 152건, 2015년 191건, 2016년 154건(항암제 임상시험의 76%)으로 나타났다. 항암제 임상시험이 활발한 것은 인구 고령화로 암환자가 증가하고 있으며, 항암제 부작용을 줄이기 위한 면역·표적 항암제 등의 최첨단 치료제가 지속적으로 개발된 데 따른 것으로 분석된다.
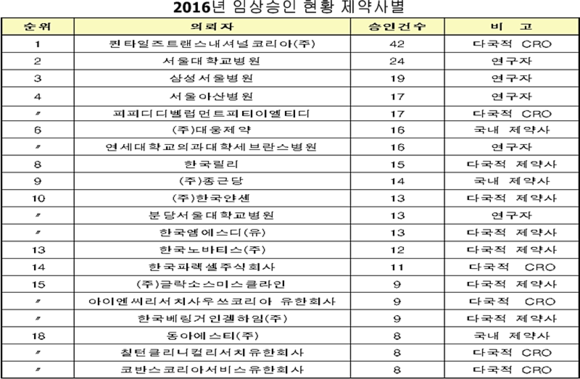
제약사별로는 국내 제약사의 경우 대웅제약이 16건으로 가장 많았고, 종근당(14건), 동아에스티(8건) 등이 뒤를 이었다. 다국적 제약사의 경우 한국릴리(15건), 한국얀센(13건), 한국엠에스디(13건) 순이었다.
연구개발 수탁전문기업(CRO)은 퀸타일즈트랜스내셔널코리아(42건), 피피디디벨럽먼트피티이엘티디(17건) 한국파렉셀주식회사(11건) 순으로 많았다.
지난해 전체 임상시험 승인건수는 628건으로 ‘15년(674건) 대비 6.8% 감소했다. 이러한 임상시험 승인건수 감소는 새로운 신약 후보물질 감소, 제네릭의약품 시장 확대 및 연구개발 생산성 저하 등으로 임상시험이 줄어들고 있는 세계적 추세가 국내에 반영된 것으로 보인다는 분석이다.
미국 임상등록 사이트(www.clinicaltrials.gov)의 전 세계 임상시험 현황을 보면 2015년 1만847건에서 2016년 8090으로 25.4% 감소했다.
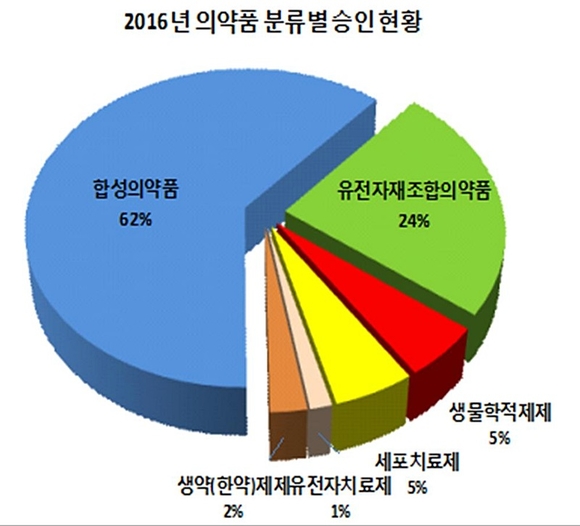
바이오의약품 임상시험은 2014년 170건에서 2015년 202건, 2016년 226건(전년대비 12% 증가)으로 대비 12% 증가한 226건이 승인됐다. 합성의약품 임상시험승인건수는 2014년 653건에서 2015년 674건, 2016년 387건으로 전년대비 14% 감소했다.
전체 임상시험에서 세포치료제·바이오시밀러 등 바이오의약품이 차지하는 비율도 2014년 26%에서 2015년 30%, 2016년 36%로 증가세를 유지했다.
바이오의약품 승인건수는 종류별로 유전자재조합(151건), 백신 등 생물학적 제제(33건), 세포치료제(33건), 유전자치료제(9건)의 순이었다.
유전자재조합의약품은 ‘15년(158건)보다 4% 감소했으나 1상 임상시험은 ‘15년 28건보다 25% 증가한 35건으로 제품화를 위한 개발 초기단계 품목이 많은 것으로 조사됐다.
세포치료제는 ‘15년(25건)에 비해 32% 증가한 33건이 승인됐으며, 자가유래 세포치료제에 비해 대량생산을 통한 상업성이 높은 동종유래 세포치료제(2015년 16건, 2016년 24건)에 대해 관심이 높아진데 따른 것으로 보인다.
동종 유래 세포치료제는 건강한 타인의 몸에서 살아있는 세포를 채취해 체외에서 배양·증식·선별 등 물리적·화학적·생물학적 방법으로 조작해 제조하는 의약품으로 대량생산이 용이하다는 장점이 있다.
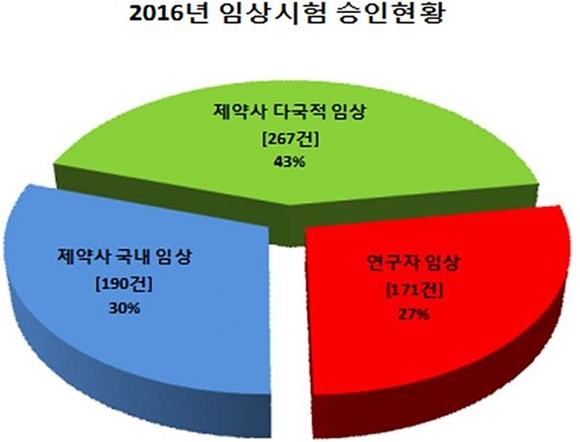
또 다른 특징은 제약사임상시험은 감소하고, 연구자임상시험은 증가한 것이다. 의약품 개발 등을 목적으로 하는 제약사임상시험은 임상시험을 국내에서만 실시하는 임상시험(국내 임상)과 국내와 다른 국가에서 동시에 실시하는 임상시험(다국가 임상)으로 나뉘며, 지난해 승인된 제약사임상시험 승인건수는 2014년 505건, 2015년 540건, 2016년 457건(저년 대비 15% 감소)으로 나타났다.
국내 임상의 경우 ‘15년 대비 22% 감소한 190건으로 1~3상에 이르는 모든 단계에서 승인 건수가 감소했으며, 이중 2상 임상시험은 ’15년 42건에서 16년 25건으로 감소폭(40%)이 두드러졌다.
다국가 임상의 경우 지난해 267건이 승인되어 ‘15년 대비 9% 감소했으며, 2상 임상시험은 ‘15년 73건에서 ’16년 71건으로, 3상 임상시험은 170건에서 136건으로 줄었으나 1상 임상시험은 ‘15년 50건에서 ’16년 57건으로 14% 증가했다.
1상 임상시험은 개발 중인 의약품을 인체에 처음 적용하는 시험인 동시에 의약품 개발 여부를 결정하는 데 핵심적인 역할을 하는 시험으로서 초기단계 다국가 임상시험이 국내에서 지속적으로 증가하는 것은 높은 규제 수준과 잘 갖추어진 임상시험기관의 인력·시설 등을 국제적으로도 인정받았기 때문으로 보인다는 설명이다.
연구자가 학술 목적으로 허가받은 의약품 등을 활용해 새로운 적응증과 용법·용량 등을 탐색하는 ‘연구자임상시험’은 지난해 171건 승인되어 `15년(37건) 대비 28% 증가했다.
연구자임상시험 증가는 새로운 제품 개발과 허가를 주요 목적으로 하는 임상시험에서 국내 의료 상황 및 환자 특성에 맞는 용법‧용량 탐색, 의약품간 상호작용 연구 등 국민 보건에 도움이 되는 다양한 임상연구가 활성화되고 있는 것으로 풀이된다.
식약처는 임상시험발전협의체 운영 등을 통해 현장의 의견을 정책에 적극 반영해 효율적이고 체계적인 임상시험을 실시할 수 있도록 지원하는 동시에 임상시험 참여자의 안전을 강화하고 환자의 알권리 확보를 위해 임상시험 정보 공개 범위를 확대해 나갈 계획이라고 밝혔다. kioo@kukinews.com
 [쿠키뉴스=조민규 기자] 지난해 차세대 항암제로 떠오르고 있는 면역항암제의 임상승인이 154건에 달하는 것으로 나타났다. 이는 항암제 전체 임상시험의 76%에 달한다.
[쿠키뉴스=조민규 기자] 지난해 차세대 항암제로 떠오르고 있는 면역항암제의 임상승인이 154건에 달하는 것으로 나타났다. 이는 항암제 전체 임상시험의 76%에 달한다. 제약사별로는 국내 제약사의 경우 대웅제약이 16건으로 가장 많았고, 종근당(14건), 동아에스티(8건) 등이 뒤를 이었다. 다국적 제약사의 경우 한국릴리(15건), 한국얀센(13건), 한국엠에스디(13건) 순이었다.
제약사별로는 국내 제약사의 경우 대웅제약이 16건으로 가장 많았고, 종근당(14건), 동아에스티(8건) 등이 뒤를 이었다. 다국적 제약사의 경우 한국릴리(15건), 한국얀센(13건), 한국엠에스디(13건) 순이었다. 국내 임상의 경우 ‘15년 대비 22% 감소한 190건으로 1~3상에 이르는 모든 단계에서 승인 건수가 감소했으며, 이중 2상 임상시험은 ’15년 42건에서 16년 25건으로 감소폭(40%)이 두드러졌다.
국내 임상의 경우 ‘15년 대비 22% 감소한 190건으로 1~3상에 이르는 모든 단계에서 승인 건수가 감소했으며, 이중 2상 임상시험은 ’15년 42건에서 16년 25건으로 감소폭(40%)이 두드러졌다. 






































